La cadena de transporte de electrones y fosforilación oxidativa
Por: Juan Luis Menéndez
Durante las primeras etapas de la respiración celular, en la glucólisis y en el ciclo de Krebs, se han ido formando una serie de moléculas reducidas, NADH y FADH2, que van a ser oxidadas en esta última etapa que se tiene lugar en la membrana interna de la mitocondria.
El último aceptor de los electrones del NADH y FADH2 es el oxígeno, O2, el cual acabará reduciéndose para formar H2O.
NADH ⟶ NAD+ + H+ + 2 e-
4 e- + 4 H+ + O2 ⟶ 2 H2O
Sin embargo, la oxidación directa del NADH y el FADH2 hasta el oxígeno libera una gran cantidad de energía que no puede captarse por la célula, por lo que el proceso tiene lugar en varios pasos en los que intervienen varios complejos que se van pasando los electrones de uno a otro, liberando cantidades de energía más pequeñas en cada salto que sí puede ser captada y aprovechada. Las moléculas que intervienen en esta oxidación consituyen lo que se conoce como cadena de transporte de electrones y son moléculas que actúan como transportadores de electrones, es decir, pueden captar y ceder electrones a otras moléculas. Generalmente son proteínas en cuya composición participan grupos o iones que son los que participan en estas reacciones de oxidación-reducción como flavinas, hierro, azufre,...
Durante la transferencia de los 4 e- desde dos moléculas de NADH o el FADH2 hasta el O2 se genera un bombeo de 20 H+ hacia el espacio intermembranoso de la mitocondria, originando una fuerza protomotriz (H+-motriz) que activa a la ATPsintasa: la fosforilación oxidativa consiste en esta fosforilación del ADP hasta ATP, y es el proceso de obtención de energía más importante de los seres vivos.
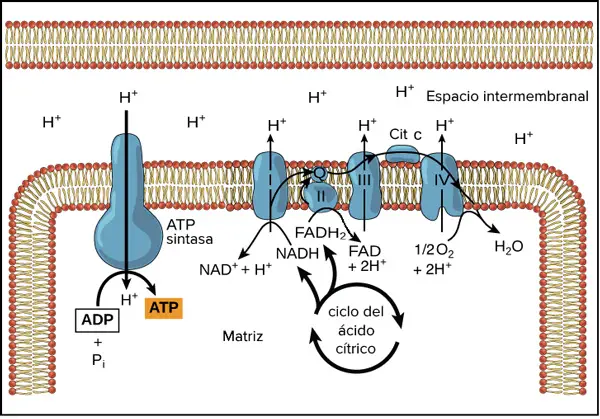
Esquema de la cadena de transporte de electrones y fosforilación oxidativa
La cadena de transporte de electrones
Los componentes de la cadena de transporte de electrones se organizan en cuatro grandes complejos proteicos denominados complejos I, II, III y IV. Además, hay otras dos proteínas, la ubiquinona y el citocromo C, que transfieren electrones entre estos complejos. Todas estas proteínas son proteínas de membrana, por lo que esta cadena de electrones se localiza en la membrana interna de la mitocondria, en las crestas mitocondriales. La cadena de electrones está organizada de tal forma que los electrones, cuando pasan de una proteína a otra, van perdiendo energía potencial hasta llegar a un aceptor final de electrones, que cuando es el O2, se reduce para formar H2O.
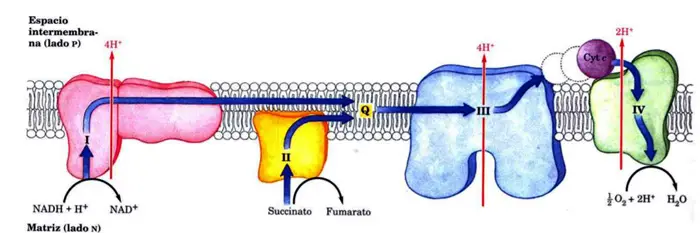
Esquema de la cadena de transporte de electrones
La cadena de transporte de electrones puede iniciarse de dos formas; bien con una molécula de NADH o bien con una molécula de FADH2, ambos originados en el ciclo de Krebs o ciclo del ácido cítrico y en otras rutas metabólicas de la célula.
En el caso del NADH los electronos pasan por los siguientes complejos:
- El NADH cede los electrones al complejo I (o NADH-deshidrogenasa o NADH:ubiquinona oxidoreductasa), que capta dos electrones del NADH y los transfiere a un transportador liposoluble denominado ubiquinona (Q). El producto reducido, que se conoce con el nombre de ubiquinol (QH2) puede difundir libremente por la membrana. El flujo de electrones ocurre de la siguiente forma: el NADH es oxidado a NAD+, y reduce al FMN a FMNH2 en un único paso que implica a dos electrones. El siguiente transportador de electrones del complejo es un centro Fe-S que solo puede aceptar un electrón y transferirlo a la ubiquinona generando una forma reducida, denominada semiquinona. Esta semiquinona vuelve a reducirse con el otro electrón que quedaba, generando el ubiquinol, QH2. Durante este proceso, cuatro protones se translocan a través de la membrana interna mitocondrial, desde la matriz hacia el espacio intermembrana y produce un gradiente de protones.
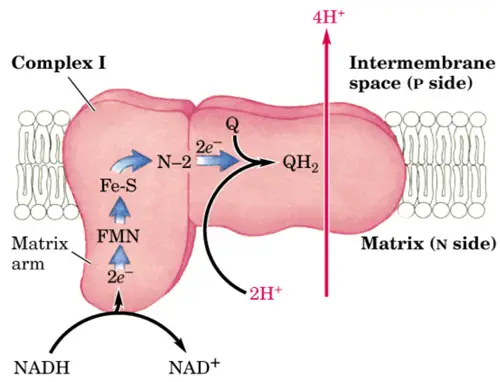
Complejo I de la cadena de electrones - El ubiquinol, QH2, es una molécula pequeña que se mueve en el interior de la membrana interna de la mitocondria y es oxidada por el complejo III (o citocromo C-reductasa), el cual obtiene dos electrones desde el ubiquinol y los transfiere a dos moléculas de citocromo c, que es un transportador de electrones hidrosoluble que se encuentra en el espacio intermembrana de la mitocondria; al mismo tiempo, transloca cuatro protones a través de la membrana por los dos electrones transportados desde el ubiquinol.
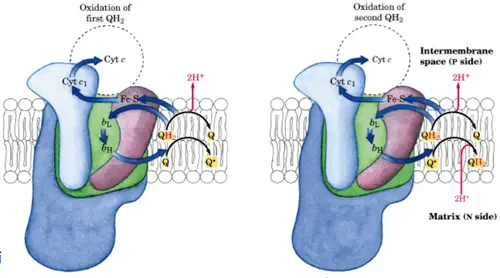
Complejo II de la cadena de electrones - El complejo IV (o citocromo C-oxidasa) capta cuatro electrones de las cuatro moléculas de citocromo c y se transfieren al oxígeno (O2), el aceptor final de electrones, para producir dos moléculas de agua (H2O). Al mismo tiempo, se translocan cuatro protones al espacio intermembrana, por los cuatro electrones. Además, desaparecen de la matriz 2 protones que pasarán a formar parte del H2O.
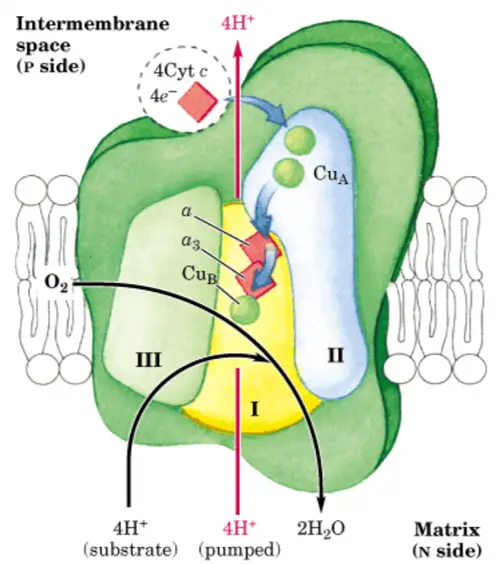
Complejo IV de la cadena de electrones
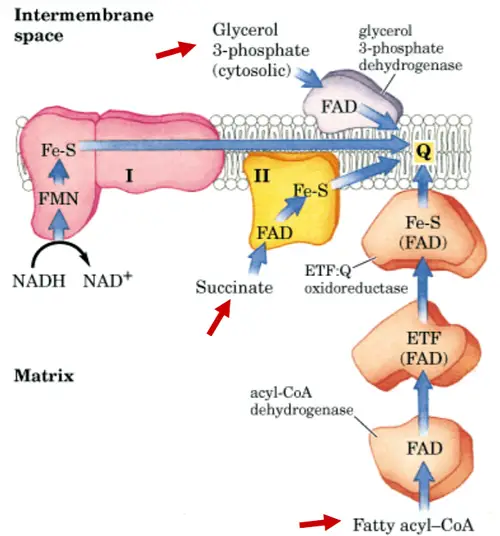
Complejo II de la cadena de electrones
NADH
El NADH es muy bueno donando electrones en reacciones redox (o sea que sus electrones están en un nivel de energía alto), por lo que puede transferir sus electrones directamente al complejo I y se transforma otra vez en NAD+. El movimiento de los electrones a través del complejo I en una serie de reacciones redox libera energía, la cual el complejo usa para bombear protones desde la matriz hacia el espacio intermembranal.FADH2
El FADH2 no es tan buen donador de electrones como el NADH (o sea que sus electrones se encuentran en un nivel de energía más bajo), por lo que no puede transferir sus electrones hacia el complejo I. En su lugar, introduce los electrones a la cadena de transporte a través del complejo II, el cual no bombea protones a través de la membrana. Debido a esto, las moléculas de FADH2 producen un menor bombeo de protones (y contribuyen menos al gradiente de protones) comparadas con las de NADH.Funciones de la cadena de electrones
La cadena de transporte de electrones tiene las siguientes dos funciones básicas:
- Regenera los acarreadores de electrones. El NADH y el FADH2 donan sus electrones a la cadena de transporte de electrones y se convierten otra vez en NAD+ y FAD. Esto es importante porque las formas oxidadas de los acarreadores de electrones se utilizan en la glucólisis y en el ciclo de Krebs, así que deben estar disponibles para mantener estos procesos en funcionamiento.
- Forma un gradiente de protones. La cadena de transporte genera un gradiente de protones a través de la membrana interna de la mitocondria: en el espacio intermembranal hay una concentración más alta de H+ mientras que en la matriz hay una concentración más baja. Este gradiente es una forma de energía almacenada que, como veremos, se puede utilizar para generar ATP.
Balance de la cadena de transporte de electrones
Hay que entender que la reducción de cada molécula de O2 por los e- aportados por 2 NADH hasta formar 2 H2O, requiere 4 e- y produce la translocación de 20 H+ al espacio intermembranoso a través de la membrana mitocondrial por los complejos I, III y IV; estos complejos funcionan como bombas de protones. Por tanto, la energía libre liberada por las reacciones redox se almacena en el gradiente de H+ acumulado en el espacio intermembranoso, que será usado en la fosforilación oxidativa para la producción de energía.
Fosforilación oxidativa
La última etapa de la respiración aerobia es la etapa en la que la célula obtiene el mayor rendimiento en forma de moléculas de ATP en un proceso diferente a la fosforilación a nivel de sustrato vista anteriormente y que es la fosforilación oxidativa.
Teoría quimiosmótica
En 1961, Peter Mitchell propuso, para explicar la síntesis de ATP en la mitocondria un mecanismo conocido como teoría quimiosmótica de acoplamiento, en la cual, como hemos visto, la energía del transporte de la cadena de electrones impulsa un sistema de transporte activo (los complejos I, III y IV), que bombea protones fuera de la matriz mitocondrial, lo cual genera un gradiente de H+ o fuerza protón-motriz con un potencial electroquímico que posibilita la síntesis de ATP mediante la activación de la ATP-sintasa.
Esta hipótesis se basa en:
- La existencia de una fuerza protón-motriz con dos componentes electro-químico. Se genera una diferencia de potencial (voltaje) transmembrana y un gradiente de pH, pHmatriz > pHintermembrana.
- Un sistema de membrana interna intacta. El uso experimental de los agentes desacoplantes, de los inhibidores y/o de los ionóforos fueron apoyos adicionales para comprobar esta hipótesis. Estos agentes son sustancias que disminuyen la fuerza protón-motriz, disminuyendo el gradiente de H+ en la membrana interna mitocondrial, como por ejemplo dinitrofenol y los compuestos ionóforos (permiten el paso de iones a través de membranas).
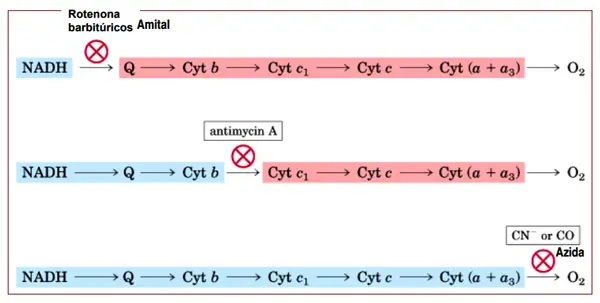
Algunos inhibidores de la cadena de transporte de electrones y lugar en el que actúan
La ATP-sintasa
Como muchos otros iones, los protones no pueden atravesar directamente la bicapa de fosfolípidos de la membrana interna de la mitocondria debido a que esta es muy hidrofóbica en su interior. Por ello, los iones H+ solo pueden moverse por su gradiente de concentración con la ayuda de proteínas de canal que forman túneles hidrofílicos a través de la membrana.
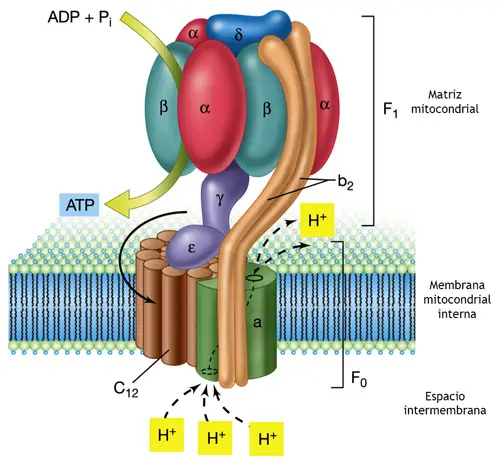
ATP-sintasa
- Unidad o factor F0, de forma esférica, dirigida hacia la matriz mitocondrial, que actúa a modo de rotor y que está formada por las subunidades a, b2 y c12.
- Unidad o factor F1, integrado en la membrana interna mitocondrial, que consta de las subunidades %α3, β3, γ, δ y ε.
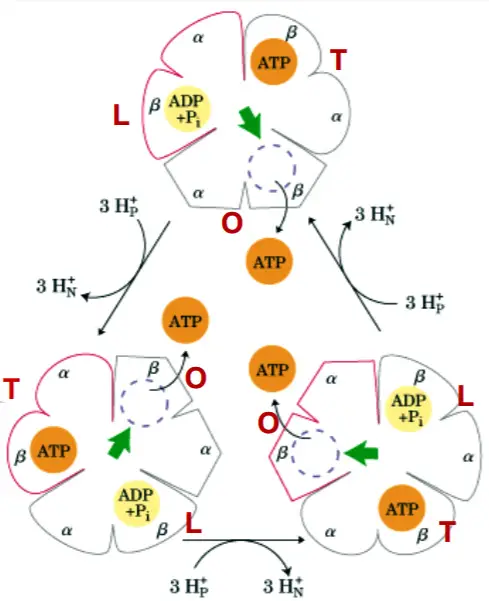
Cambios de conformación de la ATP-sintasa
- L: une ADP y Pi.
- T: sintetiza ATP.
- O: libera ATP.
Cada bombeo de protones de los complejos de la cadena de transporte de electrones desde la matriz mitocondrial al espacio intermembranoso supone la síntesis de una molécula de ATP, por lo que la entrada de un NADH en esta cadena conduce a la síntesis de 3 ATP. El paso de dos electrones del NADH al oxígeno va acompañado por una gran disminución en la energía libre, que podría hacer factible la síntesis de 7,5 moles de ATP, si se asume una energía libre de hidrólisis para el ATP de 7,3 Kcal*mol-1 o 30,5 KJ/mol ( 52,7/7,0 =7,5 ATP) o 220,286 / 30,5 = 7,3 ATP. Sin embargo, el rendimiento de la fosforilación oxidativa será sólo de aproximadamente un 41%, puesto que se sintetizan de hecho 3 ATP (aproximadamente).
2NADH ⟶ 4- ⟶ O2 ⟶ H2O | 20 H
Si es FADH2 el que inicia la cadena son dos los ATP sintetizados.
2 FADH2 ⟶ 4 e- ⟶ O2 ⟶ H2O | 12 H+ ⟶ 4 ATP | 1 FADH2 ⟶ 2 ATP
Sistema de lanzaderas
La glucolisis y otras vías metabólicas oxidativas, catabólicas, generan en el citosol cofactores reducidos, NADH, FADH2, que allí no pueden oxidarse a NAD+ y FAD para seguir actuando como coenzimas en las oxidaciones metabólicas de las nutrientes, catalizadas por las deshidrogenadas. La membrana interna de la mitocondria resulta ser impermeablev a los iones y estas moléculas reducidas que se producen, por lo que no pueden por si solas atravesar la membrana y llegar a la matriz mitocondrial para iniciar la cadena de transporte de electrones. El traspaso de este poder reductor [H] desde el citosol hacia la mitocondria para convertirlo en energía, ATP, se efectúa con reacciones soportadas en dos sistemas de lanzaderas:
- Lanzadera de glicerol-3-fosfato. Se basa fundamentalmente en la enzima glicerol-fosfato-deshidrogenasa. La glicerol-3-P deshidrogenasa es una flavo-proteína de membrana tipo complejo II. Esta proteína enzimática toma los e- del NADH citoplasmático, regenerando allí el NAD+ necesario para el metabolismo citosólico y los pasa a la CoQ, transportador móvil en la membrana interna mitocondrial. La glicerol-P deshidrogenasa es una flavoproteína, su cofactor redox es el FAD ⟶ FADH2. Estos 2e- en su paso por los complejos III y IV bombearán sólo 6H+ y por tanto la fuerza protón-motriz generada servirá para sintetizar 2 ATP. Funciona en las células del tejido muscular y cerebro.
- Lanzadera del malato-aspartato. La lanzadera malato-aspartato se basa en la función de varias proteínas: transportadoras de membrana y proteínas enzimas solubles. Entre las primeras se encuentran los sistemas de transporte de compuestos iónicos a través de la membrana interna mitocondrial y entre las segundas las enzimas malato deshidrogenasa, MDH, glutamato, oxalacetato transaminasa y GOT. Los NADH citosólicos ceden sus e- al oxalacetato, que se reduce a malato y entra a la mitocondria. Los 2e- del NADH citosólico que entran con el malato acaban como NADH mitocondriales que descargan en la cadena de transporte electrónico y bombearán 10 H+ y rendirán el potencial suficiente para sintetizar 3 ATP. Funciona en las células del hígado y del corazón.
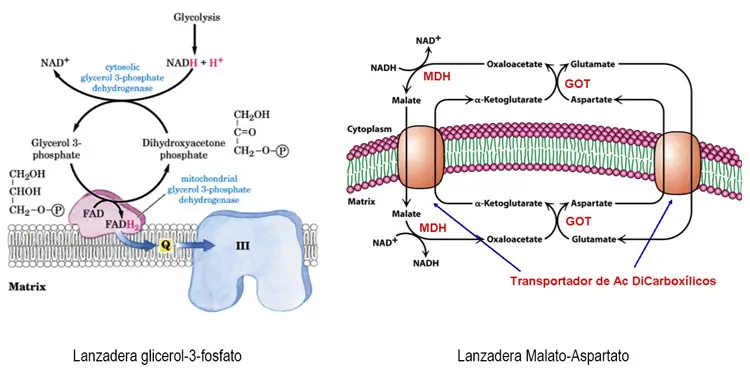
Sistemas de lanzadera y funcionamiento
Hashtags:
#metabolismo#catabolismo#respiracion-celular#ciclo-de-krebs#fermentacion#glucolisis#fosforilacion#transporte-de-electrones
Juan Luis Menéndez
Me gusta la divulgación de la naturaleza y el patrimonio cultural, motivos por los que he decidido comenzar el desarrollo de asturnatura.com. Soy un amante de la botánica y la geología.
Artículos similares
Citar como
Menéndez Valderrey, Juan Luis. "La cadena de transporte de electrones y fosforilación oxidativa". asturnatura.com [en línea] Num. 839, 26/04/2021 [consultado el 17/5/2023]. Disponible en https://www.asturnatura.com/temarios/biologia/catabolismo/cadena-transporte-electrones.
ISSN 1887-5068