Regulación del metabolismo
Por: Juan Luis Menéndez
En la complicada maraña de reacciones químicas que forman parte del metabolismo, muchas de ellas presenta algunos controles de las mismas. Sin embargo, el estudio individualizado de reacciones y rutas metabólicas, puede producir la impresión errónea de que cada reacción o ruta funciona con independencia de las demás; más bien todo lo contrario. Debe quedar claro, que ciertamente cada una de las vías tiene una regulación propia, pero existe una estrecha interrelación entre ellas, y la actividad de todas se halla integrada en el metabolismo corporal. Aunque los procedimientos de control resulten complejos, todos ellos suelen responder a unas estrategias comunes que, ajustadas siempre al principio de economía celular, permiten que con pocas variantes puedan ser aplicados a todas las rutas metabólicas.
La regulación de los procesos metabólicos es necesaria para equilibrar el aporte de materia y energía en los diversos momentos de la vida celular. La presencia de gran cantidad de nutrientes, activará rutas de aprovechamiento de los mismos; mientras que en periodos de carencia, la célula utilizará las reservas almacenadas anteriormente. En los seres vivos, las rutas sintéticas y degradativas para los mismos metabolitos coexisten, y, además, están diseñadas para que funcionen en sentido unidireccional, tener ambas trabajando al mismo tiempo supone un despilfarro energético sin sentido. Para evitarlo, se ha de realizar una integración que decida en cada momento el sentido más conveniente en el que ha de funcionar el metabolismo.
La regulación metabólica puede ejercerse a varios niveles:
- A nivel molecular. Se controlan las moléculas que participan en las reacciones metabólicas como las enzimas actuando bien sobre la concentración de la enzima (inhibiendo o induciendo la síntesis proteica) o bien sobre su actividad. Esto último se puede hacer mediante:
- Modificaciones no covalentes como el alosterismo. Este tipo de regulación afecta a enzimas formadas por dos o más cadenas polipeptídicas que regulan etapas claves de una ruta metabólica que generalmente corresponden a las primeras reacciones de la ruta. Existen moléculas que actúan como moduladores o efectores alostéricos que se unen a una región de la enzima diferente al centro activo modificando la forma de la enzima y haciendo que el sitio activo se más o menos accesible para el sustrato.
- Modificaciones covalentes. Muchas enzimas reguladoras, además de las interacciones alostéricas, están controladas por modificación covalente. La modificación consiste en una reacción catalizada por otra enzima u otras enzimas. La adición o separación de un grupo funcional a la enzima cambia su estado de actividad. Normalmente el grupo suele ser un fosfato, y el ciclo fosforilación-defosforilación sobre un aminoácido de una proteína (habitualmente serina o treonina) modifica sus propiedades, en particular en lo que se refiere a su actividad catalítica. Las modificaciones covalentes constituyen el punto final de una cascada de amplificación, tal y como se estudiará más adelante, que puede conectar o interrumpir una vía metabólica por una señal informativa..
- A nivel celular. En las células eucariotas, determinadas rutas metabólicas se llevan a cabo dentro de un compartimento u orgánulo subcelular, catalizándose por enzimas diferentes. Como ejemplo tenemos la oxidación de los ácidos grasos que transcurre en la matriz mitocondrial, mientras que la biosíntesis de ácidos grasos tiene lugar en el citosol.
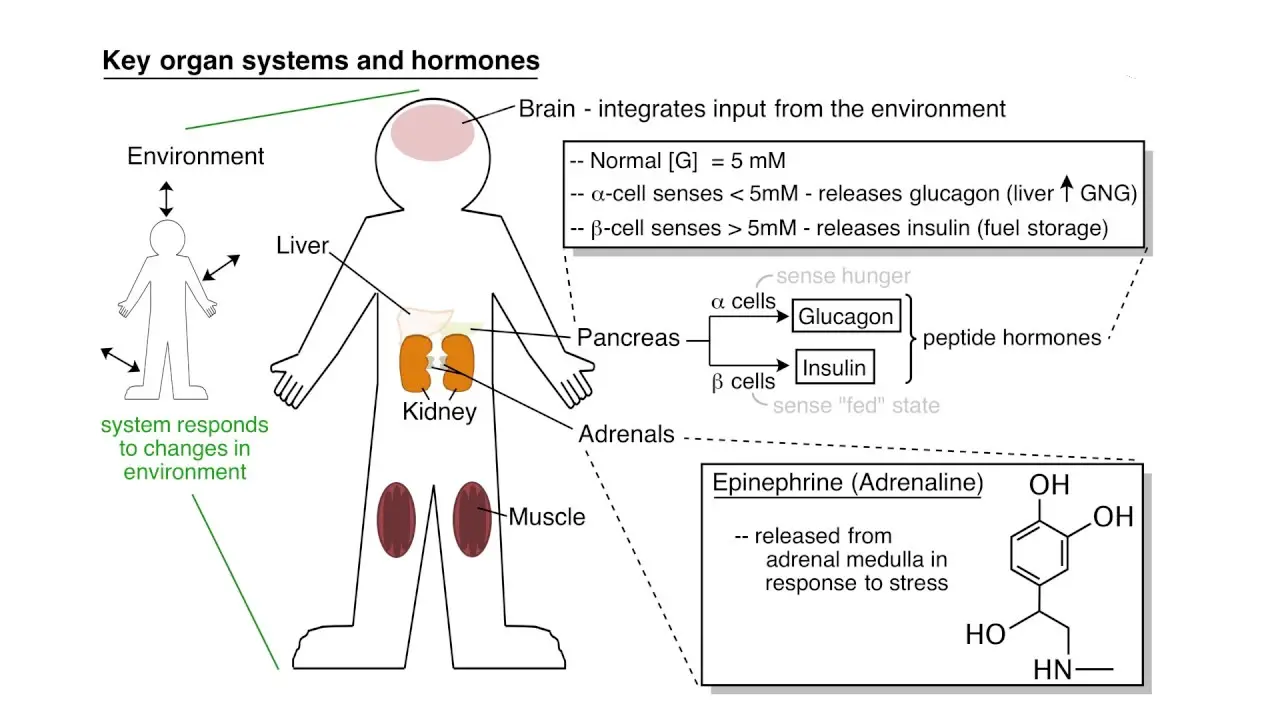
- A nivel corporal. En organismos pluricelulares como el ser humano, al estar formados por gran cantidad de células es necesaria la existencia de sistemas de integración que permitan una acción concertada de células, órganos y sistemas. Los principales sistemas de integración metabólica son el sistema hormonal y el sistema nervioso.
Cada órgano o tejido del cuerpo presenta unas funciones específicas, que determinan el tipo de patrón o perfil metabólico que utilizará. Así, el tejido nervioso, el muscular, el adiposo o el hígado son órganos importantes que utilizan criterios distintos a la hora de satisfacer sus necesidades energéticas. Por otro lado, hay que añadir que existen dos grandes estados del organismo, saciedad y ayuno, que van a sesgar el perfil metabólico de cada órgano, adaptándolo a cada una de las dos situaciones. Para lograr esa interrelación entre unos y otros órganos, se utilizará el control hormonal y nervioso. Se describen a continuación, los patrones metabólicos de algunos de los órganos más relevantes.
El hígado
El hígado es el órgano central de procesamiento y reparto de los nutrientes al resto de los tejidos del organismo; estos tejidos se denominan de forma genérica tejidos extrahepáticos o periféricos. La actividad metabólica del hígado es esencial para suministrar combustible al cerebro, al músculo y al resto de los tejidos del cuerpo. La mayoría de los nutrientes absorbidos por el intestino pasan a la sangre y son captados por los hepatocitos. Las clases y cantidades de nutrientes que llegan al hígado son muy variables dependiendo del tipo de dieta y la cantidad de ingesta que se realice. El hígado procesa estas moléculas, convirtiéndolas en compuestos utilizables por el resto de las células, liberándolos a sangre y regulando de esta forma el nivel de muchos metabolitos en la corriente sanguínea. Según el predominio de unos u otros nutrientes presentes en la dieta el hígado puede modificar rápida y sencillamente su perfil metabólico.
Si se analiza el metabolismo de los glúcidos, el hígado puede retener grandes cantidades de glucosa en forma de glucógeno, pudiendo llegar a almacenar hasta 400 Kcal en forma polimérica. En caso de sobreabundancia por ingesta elevada, y cuando las reservas glucídicas están completas, el hepatocito degrada la glucosa a acetil-CoA para formar ácidos grasos y desviarla hacia los depósitos lipídicos. En caso de caída de la glucemia, la degradación del glucógeno almacenado y la gluconeogénesis con lactato y alanina del músculo, glicerol del tejido adiposo, y aminoácidos glucogénicos, le capacitan para formar y liberar glucosa a la sangre.
Cuando los combustibles son abundantes, el hígado esterifica los ácidos grasos procedentes de la dieta y los libera a sangre en forma de lipoproteínas de muy baja densidad. En los adipocitos, estas lipoproteínas se convierten en el principal suministrador de ácidos grasos para sintetizar triacilgliceroles. En situación de ayuno, convierte los ácidos grasos en cuerpos cetónicos que exporta para suministrar combustible a los tejidos periféricos. La discriminación entre ambos caminos, sintético o degradativo, es capaz de realizarla por la localización de los ácidos grasos. En situación de abundancia, se bloquea la entrada de los ácidos grasos a la mitocondria, permaneciendo en el citoplasma donde se esterifican y se envían al tejido adiposo para su almacenamiento. En el caso de carencia de combustible los ácidos grasos que salen de los adipocitos, en el hígado son convertidos en cuerpos cetónicos y éstos se distribuyen como metabolitos combustibles.
Los aminoácidos pueden ser utilizados en condiciones de abundancia para la síntesis proteica hepática, ya que en el hígado el recambio proteico es extraordinariamente elevado; o bien pueden ser exportados para sostener la síntesis proteica de otros órganos. Los aminoácidos excedentes del recambio proteico, se oxidan a acetil-CoA y son desviados a depósitos lipídicos.
Para sus necesidades energéticas el hígado utiliza preferentemente cetoácidos procedentes de la degradación de aminoácidos, ya que la glucólisis se usa como vía para obtener precursores biosintéticos, y los cuerpos cetónicos no pueden ser utilizados por carecer de enzima que degrade el acetoacetato. En resumen, su función es la de organizar el reparto de nutrientes, balanceando las fluctuaciones metabólicas que se producen por la entrada intermitente de alimentos.
Cerebro
La glucosa es prácticamente el único combustible utilizado por el cerebro humano, excepto durante el ayuno prolongado. Al carecer de sistema de almacenamiento, este órgano necesita un suministro continuo de glucosa. Cuando la glucemia está en valores normales de 4,7 mM (85 mg/dl) en el cerebro se mide 1 mM, si el nivel de glucosa en sangre desciende, por debajo de un nivel crítico, el proceso de la glucólisis empieza a enlentecerse. En esta situación pueden producirse cambios en el funcionamiento cerebral, con el peligro que conlleva no sólo para el cerebro sino para todo el organismo. El cerebro consume unos 120 gramos de glucosa al día lo que supone unas 420 Kcal. En estado de reposo prácticamente el 60 % de la glucosa utilizada por todo el organismo se oxida totalmente en las neuronas. Esta degradación oxidativa lleva aparejada un elevado consumo de oxígeno, lo que en reposo supone aproximadamente un 20 % del total gastado por el organismo. Durante el ayuno prolongado, los cuerpos cetónicos (acetato y 3-hidroxi-butirato), sintetizados en el hígado, reemplazan en parte a la glucosa como combustibles cerebrales. La degradación del acetoacetato proporciona dos moléculas de acetil-CoA, que penetran en el ciclo del ácido cítrico rindiendo energía. Los ácidos grasos no pueden ser utilizados porque al ir unidos en plasma a la albúmina no pueden atravesar la barrera hematoencefálica, en su sustitución se utilizan los cuerpos cetónicos. Este cambio en el combustible mayoritario de las neuronas permite reducir al mínimo la destrucción de proteínas durante el ayuno.
Músculo
La función básica del músculo esquelético es la contracción, y para poder realizarla todo su metabolismo está dirigido a la obtención de ATP. Como la actividad muscular es intermitente, las necesidades de ATP no son siempre las mismas y el perfil metabólico presentará variaciones según las exigencias energéticas del momento.
Los principales combustibles del músculo son glucosa, ácidos grasos y cuerpos cetónicos. El músculo difiere del cerebro en que posee una gran capacidad de almacenamiento de glucógeno, de hecho las 3/4 partes de las reservas de glucógeno del organismo están en el músculo. Este depósito glucídico puede movilizarse para dar glucosa-6-fosfato y satisfacer las necesidades metabólicas. A diferencia del hepatocito, la fibra muscular carece de glucosa-6-fosfatasa, y, por lo tanto, no puede liberar glucosa a la sangre, la retiene y oxida, sirviéndole como el mejor combustible para sus estallidos de actividad. En el músculo esquelético en contracción activa, la velocidad de la glucólisis es mucho mayor que la del ácido cítrico, por lo que el piruvato se reduce a lactato (fermentación láctica), que fluye hacia el hígado (ciclo de Cori) donde se convierte en glucosa, logrando así desviar parte de la carga metabólica del músculo al hígado.
Cuando el músculo está en reposo, su actividad metabólica es muy distinta, su principal combustible son los ácidos grasos provenientes del tejido adiposo y los cuerpos cetónicos, ambos se oxidan a acetil-CoA y proporcionan energía. El músculo cardíaco, a diferencia del esquelético está activo continuamente, además, carece de depósitos energéticos y depende constantemente del suministro de glucosa, ácidos grasos y cuerpos cetónicos de la sangre. En este tipo de células, los cuerpos cetónicos son utilizados preferentemente a la glucosa. Su metabolismo es aerobio de forma permanente, para lo que dispone de un número de mitocondrias mucho mayor que en el músculo esquelético, y por la misma razón también es mucho más dependiente del suministro de oxígeno desde la sangre.
Tejido adiposo
El tejido adiposo está formado por las células adiposas o adipocitos, de amplia distribución en el organismo. Son células metabólicamente muy activas, que juntamente con los tejidos descritos realizan una regulación metabólica integrada de todo el organismo. La mayor parte de las reservas almacenadas en estas células son triacilgliceroles y constituyen un enorme depósito de combustible metabólico. El 15 % de la masa de un individuo adulto es tejido adiposo, lo que en un hombre de unos 70 Kg, supone un contenido energético de unas 140.000 Kcal.
El tejido adiposo tiene un metabolismo oxidativo y satisface sus necesidades energéticas oxidando glucosa y ácidos grasos. Pero su función específica es la esterificación de los ácidos grasos para formar triacilgliceroles (lipogénesis), y su hidrólisis liberando ácidos grasos (lipolisis).
La síntesis de ácidos grasos se realiza en el hígado, en el tejido adiposo se realiza la condensación de estas moléculas lipídicas, por lo que la biosíntesis se reduce a la activación de estos ácidos grasos y su unión con el glicerol. El glicerol-3-fosfato es un intermediario clave que procede de un metabolito glucolítico, por este motivo las células adiposas necesitan glucosa para poder sintetizar triacilgliceroles.
Los triacilgliceroles están hidrolizándose y resintetizándose continuamente; si el nivel de glucosa es alto hay abundancia de glicerol-3-fosfato y la mayoría de los ácidos grasos se reesterifican de nuevo, pero si la cantidad de glucosa presente es escasa, habrá carencia de glicerol-3-fosfato, y los ácidos grasos no se esterifican y salen libres a sangre. De este modo, el nivel de glucosa en las células adiposas es el principal factor que determina la liberación o no de los ácidos grasos a plasma. Existe, además, una regulación hormonal, ya que la enzima que cataliza la separación del primer ácido graso es una lipasa sometida a un estrecho control.

Juan Luis Menéndez
Me gusta la divulgación de la naturaleza y el patrimonio cultural, motivos por los que he decidido comenzar el desarrollo de asturnatura.com. Soy un amante de la botánica y la geología.
Artículos similares
Citar como
Notice: Trying to access array offset on value of type null in /web/htdocs/www.asturnatura.com/home/temarios/articulocapitulo.php on line 372
Menéndez Valderrey, Juan Luis. "Regulación del metabolismo". asturnatura.com [en línea] Num. 0, [consultado el 17/5/2023]. Disponible en https://www.asturnatura.com/temarios/biologia/metabolismo/regulacion.
ISSN 1887-5068